Por Sonia MR Vasconcelos*,**, Adriana B Graça**, Christiane C Santos***, Karina A Rocha*, Maria Júlia M Antunes*, Mariana D Ribeiro* e Marlise Pedrotti*
A pandemia de COVID-19: Há mais de um ano…
O último dia do ano de 2019 marcou o início oficial de uma grande mudança no planeta, que “… virou o mundo de cabeça para baixo. Tudo foi impactado. Como vivemos e interagimos uns com os outros, como trabalhamos e nos comunicamos, como nos movemos… Cada aspecto de nossas vidas foi afetado.”1 No dia 31 de dezembro de 2019, a Organização Mundial da Saúde (OMS) foi informada sobre a ocorrência de casos atípicos de pneumonia na cidade de Wuhan, na China. A disseminação do surto teria se iniciado em um mercado de frutos do mar e animais vivos, uma hipótese bastante difundida. Porém, até hoje, a OMS ainda não pode afirmar a real origem, de acordo com seu mais recente relatório.
O agente causador do surto identificado em Wuhan foi um novo coronavírus, que seria posteriormente denominado SARS-CoV-2, pelo Comitê Internacional de Taxonomia de Vírus. Em 30 de janeiro de 2020, a OMS declarou aquele surto como Emergência de Saúde Pública de Importância Internacional – no mesmo mês em que houve o registro da primeira morte associada ao vírus, na China. Semanas depois, em 11 de fevereiro de 2020, a doença provocada pelo novo coronavírus passou a ser chamada, pela OMS, de COVID-19 – em referência ao tipo de vírus e ao ano de início da epidemia.
No Brasil, no dia 6 de fevereiro de 2020, foi publicada no Diário Oficial da União a Lei 13.979,2 com “…medidas para enfrentamento da emergência de saúde pública de importância internacional decorrente do coronavírus responsável pelo surto de 2019.”2 Ao decretar a Lei sancionada pela Presidência da República, o Congresso Nacional determinou que, “para enfrentamento da emergência de saúde pública de importância internacional decorrente do coronavírus”, uma série de medidas seriam necessárias. No texto da referida Lei inclui-se “isolamento”, “quarentena”, “realização compulsória de exames médicos” e “restrição excepcional e temporária de entrada e saída do País…”, dentre várias outras ações.2 Semanas depois, em 26 de fevereiro, a primeira morte por COVID-19 foi confirmada pelo Ministério da Saúde.
Com o avanço dos casos em vários países, a COVID-19 foi caracterizada pela OMS como uma pandemia, em 11 de março de 2020. Naquele momento, havia uma incerteza natural sobre a dimensão do problema. A OMS ainda não tinha registro de casos para 81 países e, para outros 57, o registro era de dez casos ou menos. No entanto, a Organização alertava o mundo, naquele mesmo dia, sobre os mais de 118 mil casos de COVID-19, em mais de 100 países, já havendo mais de quatro mil mortes registradas. A OMS descreve a COVID-19 como:
…uma doença infecciosa causada pelo novo coronavírus (SARS-CoV-2) e tem como principais sintomas febre, cansaço e tosse seca. Alguns pacientes podem apresentar dores, congestão nasal, dor de cabeça, conjuntivite, dor de garganta, diarreia, perda de paladar ou olfato, erupção cutânea na pele ou descoloração dos dedos das mãos ou dos pés. Esses sintomas geralmente são leves e começam gradualmente. Algumas pessoas são infectadas, mas apresentam apenas sintomas muito leves. A maioria das pessoas (cerca de 80%) se recupera da doença sem precisar de tratamento hospitalar. Uma em cada seis pessoas infectadas por COVID-19 fica gravemente doente e desenvolve dificuldade de respirar. As pessoas idosas e as que têm outras condições de saúde como pressão alta, problemas cardíacos e do pulmão, diabetes ou câncer, têm maior risco de ficarem gravemente doentes. No entanto, qualquer pessoa pode pegar a COVID-19 e ficar gravemente doente.3
Desde o reconhecimento internacional de que o cenário que se configurava era uma pandemia, a COVID-19 ganhou uma proporção avassaladora. Segundo a OMS, já foram confirmados no mundo mais de 130 milhões de casos de COVID-19 e mais de dois milhões e oitocentas mil mortes decorrentes da doença, até o dia 04 de abril de 2021. Os casos de COVID-19 estão espalhados por quase todo o planeta. Felizmente, neste momento em que falamos desse problema, vários países já iniciaram a vacinação, como China, Reino Unido, Estados Unidos e vários outros, incluindo o Brasil. No país, é importante destacar o pioneirismo do Instituto Butantan e da Fundação Oswaldo Cruz (Fiocruz).
Além das vacinas já aprovadas em diversos países, até 6 de janeiro de 2021, “havia 63 vacinas candidatas em fase de avaliação clínica em humanos, além de 172 em fase de pesquisas pré-clinicas.”4 Esses números refletem uma atividade de pesquisa sobre COVID-19, envolvendo seres humanos, intensa e veloz, considerando o período de menos de um ano desde o reconhecimento da pandemia pela OMS.
Pesquisa em humanos na pandemia – estudos clínicos ganham espaço destacado
Segundo dados do relatório do Global Data,5 o número de estudos clínicos sobre a COVID-19 teve um aumento de 639%. O relatório indica que havia registro de 549 estudos clínicos relacionados à doença no início de abril de 2020. Até janeiro de 2021, já eram 4000 registrados.
Neste cenário de pandemia, há um tipo de estudo que vem ganhando um espaço destacado em publicações científicas e na mídia, os chamados “human challenge trials” – estudos clínicos com desafio em humanos ou de desafio humano/em humanos. Diferente dos estudos clínicos convencionais, nos estudos com desafio, “…os voluntários são tipicamente randomizados para receber a vacina que está sendo investigada ou um controle (uma vacina comprovada, uma vacina experimental ou um placebo).”6 Esses participantes de pesquisa, em geral jovens e saudáveis, são depois intencionalmente infectados pelo vírus, em condições controladas pela equipe de pesquisa, ao invés de esperarem o contágio natural, como ocorre em estudos clínicos convencionais.
Esse tipo de estudo nos convida a uma reflexão sobre várias questões éticas, que vêm atraindo a atenção de pesquisadores nas áreas clínicas, em ética em pesquisa/bioética e, também, de uma parcela do público, no Reino Unido, por exemplo. Antes de abordarmos algumas das preocupações de natureza ética, vale ressaltar que, quando falamos do público neste cenário de pandemia, há dois movimentos importantes. Por um lado, há um enorme desafio relacionado ao fluxo de desinformação pública, alertado pelas Nações Unidas e pela OMS nos primeiros meses da pandemia. Por outro lado, se ampliam as possibilidades do público se familiarizar com informações científicas sobre saúde pública e sobre a COVID-19, embora a compreensão dessas informações não possa ser assumida.
No caso de estudos clínicos, o público vem cada vez mais se deparando com informações, por exemplo, que incluem menção às fases que compõem esses estudos, pela própria OMS e outras organizações de saúde, por cientistas, autoridades sanitárias e pela mídia. A Organização Pan-Americana de Saúde (OPAS), por exemplo, divulgou, há alguns meses, perguntas frequentes sobre as vacinas candidatas contra a COVID-19 e os mecanismos de acesso,4 um dos vários documentos informativos, em língua portuguesa. Como descrito nessa folha informativa, no caso de “vacinas candidatas”, a “avaliação… passa por diferentes fases (pré-clínica e clínica) até que receba aprovação regulatória. O objetivo de todo esse processo é garantir uma vacina segura e eficaz.”4
Informações sobre as fases dos estudos clínicos também são facilmente acessíveis, por exemplo, no website da Fiocruz e do Instituto Butantan:
Fase I: é o primeiro estudo a ser realizado em seres humanos e tem por objetivo principal demonstrar a segurança da vacina. Fase II: tem por objetivo estabelecer a sua imunogenicidade. Fase III: é a última fase de estudo antes da obtenção do registro sanitário e tem por objetivo demonstrar a sua eficácia. Somente após a finalização do estudo de fase III e obtenção do registro sanitário é que a nova vacina poderá ser disponibilizada para a população.7
Estudos com desafio em humanos – debate sobre questões éticas revigorado
Os estudos com desafio em humanos são raros, comparados com estudos clínicos convencionais, o que naturalmente reflete um espaço mais restrito de informações acessíveis ao público, como documentos relacionados. Em termos de relevância científica, esses estudos podem ser importantes para a condução de alguns dos próprios estudos clínicos convencionais. Em um relatório de um Grupo de Trabalho da OMS, publicado no periódico Vaccine, em janeiro de 2021, onde são citados vários artigos científicos, é considerado que
Os estudos de desafio de SARS-CoV-2 podem agregar valor a outros tipos de pesquisa de vacinas, permitindo (a) avaliação precisa da infecção assintomática, (b) teste mais rápido e padronizado de múltiplas vacinas candidatas, e (c) teste de vacinas em contextos onde há pouca transmissão contínua. 8
Nesses estudos, a seleção de voluntários jovens e saudáveis, além dos protocolos para monitorar e cuidar desses participantes de pesquisa após a infecção deliberada, estão dentre as características que, para alguns pesquisadores, torna esse tipo de estudo defensável, especialmente na pandemia de COVID-19.
Porém, pesquisas em seres humanos e questões éticas estão imbricadas, o que fica ainda mais evidente para esse tipo de estudo. Para o Professor Joerg Hasford, Presidente da Associação dos Comitês de Ética Médica da Alemanha:
O conceito de um teste com desafio em humanos é que todos os participantes sejam primeiro vacinados com placebo ou com a vacina teste e, em seguida, sejam intencionalmente expostos a uma dose suficientemente alta de SARS-CoV-2, para que todos os participantes possam ser considerados infectados. Sendo todos expostos, a eficácia de uma vacina pode ser avaliada com tamanhos de amostra consideravelmente menores e, possivelmente, mais rapidamente, em comparação com um estudo clínico convencional com participantes da comunidade. 9
Hasford argumenta ainda que
… um teste com desafio em humanos não fornece nenhum benefício direto para os participantes de pesquisa [indivíduos que se voluntariam/voluntários]. Uma outra questão ética importante é que, desde Hipócrates, os médicos foram solicitados a obedecer a dois princípios: beneficência e não maleficência. Ambos ainda são indispensáveis e apresentam uma parte essencial da ética deontológica. Beneficência significa que o médico deve tomar medidas positivas para contribuir para o bem-estar das pessoas. O princípio da não maleficência é frequentemente resumido em: ‘Acima de tudo, não cause mal [ou dano].’ É óbvio que a infecção intencional de pessoas, mesmo que sejam voluntárias, significa um nítido contraste, por parte dos médicos, com esses dois princípios que ainda hoje fazem parte do juramento hipocrático. O principal pressuposto de estudos com desafio em humanos é que o dano deve ser feito para evitar maiores danos à sociedade. Não há dúvida, e os proponentes desses estudos também admitem, que fatalidades podem ocorrer em tais estudos.9
Hasford está dentre as muitas vozes que vêm se manifestando sobre estudos com desafio em humanos na pandemia de COVID-19. Josh Morrison também é uma delas. Morrison não é cientista, mas sentiu a necessidade de ampliar o impacto de uma possível vacina contra a COVID-19 para um maior número possível de pessoas e países, quando ainda não havia nenhuma vacina aprovada. A iniciativa liderada por Morrison, 1Day Sooner ou “Um Dia Mais Cedo” reúne voluntários saudáveis dispostos a serem infectados com o novo coronavírus para acelerar o desenvolvimento de vacinas e o conhecimento sobre a COVID-19. Hoje, a iniciativa de Morrison conta com milhares de voluntários. Até 04 de abril de 2021, o website indicava mais de 38 mil pessoas, em 166 países, segundo dados da iniciativa. A ideia de “motivação altruísta” vem sendo associada às motivações dos voluntários.
É importante ressaltar que a utilização de estudos com desafio em humanos não é novidade no ambiente científico. Pesquisadores já usaram esse modelo na pesquisa para o desenvolvimento de vacinas contra outras doenças, como a malária, a dengue e o cólera.
Porém, como refletido na crítica expressa por Hasford,9 esse fato não torna simples uma discussão tão complexa, sobre esse tipo de estudo na pandemia de COVID-19. Em julho de 2020, uma publicação na Science chamou atenção para esse problema. Intitulada “Controversial ‘human challenge’ trials for COVID-19 vaccines gain support,”10 a publicação indica que a discussão sobre questões éticas relacionadas a esses estudos está bem longe de terminar. Em novembro de 2020, semanas antes da oficialização da aprovação da primeira vacina no Reino Unido, uma publicação no BMJ,11 apresentou um contraponto. Enquanto Josh Morrison, um dos autores dessa publicação, exorta a sociedade a abraçar o altruísmo de indivíduos que se voluntariam para esse tipo de estudo, Charles Weijer, um bioeticista especializado no estudo da ética em estudos clínicos, considera a iniciativa perigosa e injustificada. Dentre as preocupações éticas, destacam-se a avaliação dos riscos e benefícios e a preocupação com a segurança desses voluntários.
A ética em pesquisa continua sendo a grande aliada
Nesse contexto, pode parecer que não existem orientações internacionais de cunho ético sobre estudos com desafio em humanos relacionados à COVID-19. Porém, a OMS publicou diretrizes para a condução desse tipo de estudo. O documento “Key criteria for the ethical acceptability of COVID-19 human challenge studies”da OMS, de maio de 2020,12 fornece orientações para cientistas, Comitês de Ética em Pesquisa, financiadores, formuladores de políticas e reguladores, nas deliberações sobre os estudos com desafio em humanos no combate à COVID-19. O documento lista oito critérios éticos que devem ser considerados para a aprovação desses estudos.
De acordo com o referido documento,12 na etapa de avaliações científicas e éticas, a orientação é que esses estudos tenham uma forte justificativa científica e deve se esperar que os benefícios potenciais superem os riscos; para a etapa de consulta e coordenação, os programas de pesquisa devem ser informados por consulta e engajamento do público, bem como de especialistas e formuladores de políticas. Devem também envolver uma forte interação entre pesquisadores, financiadores, formuladores de políticas e reguladores. Sobre os critérios de seleção, os estudos com desafio em humanos devem ser realizados onde a pesquisa possa ser conduzida com os mais altos padrões científicos e éticos. Tais pesquisas devem garantir que os critérios de seleção dos participantes limitem e minimizem os riscos; para a etapa de revisão e consentimento, a orientação é que os estudos sejam revisados por um comitê especializado independente e envolvam um rigoroso consentimento informado dos participantes, que chamamos de consentimento livre e esclarecido no Brasil.
Porém, de forma geral, os aspectos regulatórios, nos vários países, contemplam, em sua maioria, estudos clínicos convencionais.13 Por exemplo, se considerarmos o panorama de políticas governamentais para a condução de estudos clínicos, a ClinRegs é uma base de dados de caráter informativo que reúne informações internacionais sobre a regulação da pesquisa clínica. Essa base não disponibiliza detalhes sobre a regulação de estudos com desafio em humanos.14 A base é associada ao Instituto Nacional de Alergia e Doenças Infecciosas (National Institute of Allergy and Infectious Diseases, NIAID) dos Estados Unidos, que divulga políticas públicas sobre a pesquisa clínica adotadas por diversos países.
Nos Estados Unidos, por exemplo, aspectos regulatórios sobre a pesquisa clínica podem ser identificados na atuação do FDA (Food and Drug Administration, Administração Federal de Alimentos e Medicamentos). O FDA é associado ao Departamento de Saúde e Serviços Humanos (Department of Health and Human Services, HHS) e tem um papel muito importante na regulação da pesquisa clínica. Como descrito no documento “Conducting Clinical Trials”,15 o FDA se compromete a “proteger os participantes dos estudos clínicos, bem como oferecer informações confiáveis aos interessados em participar nos estudos.” O FDA estabelece diretrizes para a pesquisa clínica que, aliadas às de outros órgãos reguladores, como os Institutional Review Boards (IRBs, Comitês de Revisão Institucional), contribuem para proteger os participantes de pesquisa de riscos injustificáveis:
De acordo com os regulamentos da FDA, um Comitê de Revisão Institucional é um grupo que foi formalmente designado para revisar e monitorar pesquisas biomédicas envolvendo seres humanos. De acordo com os regulamentos da FDA, um IRB tem autoridade para aprovar, exigir modificações (para garantir a aprovação) ou reprovar pesquisas. Essa revisão em grupo tem um papel importante na proteção dos direitos e do bem-estar dos participantes de pesquisa. O objetivo da revisão do IRB é garantir, com antecedência e por meio de revisão periódica, que medidas apropriadas sejam tomadas para proteger os direitos e o bem-estar dos seres humanos que participam da pesquisa.16
Na China, a “Administração Estatal de Medicamentos” é o órgão que é responsável pela regulamentação, aprovação e supervisão de estudos clínicos. Já no Reino Unido, quem faz esse tipo de regulação da pesquisa clínica é a Agência Reguladora de Medicamentos e Produtos de Saúde (Medicines and Healthcare products Regulatory Agency, MHRA). Assim como nos Estados Unidos, com a atuação dos IRBs, em ambos os países, também é necessária a análise ética da proposta, pelas instâncias responsáveis, para a condução da pesquisa clínica.
Quanto ao Brasil, a Agência Nacional de Vigilância Sanitária (Anvisa), é a autoridade reguladora responsável pela aprovação, supervisão e inspeção de estudos clínicos. A Anvisa é independente, mas vinculada ao Ministério da Saúde. Dentre as várias atribuições da Agência, ela tem o papel de “inspecionar os centros de pesquisa brasileiros para verificar a aderência às Boas Práticas Clínicas nos estudos clínicos.”17 A Anvisa analisa estudos clínicos regulatórios e vêm tendo um papel marcante na aprovação desses estudos sobre COVID-19 no Brasil.
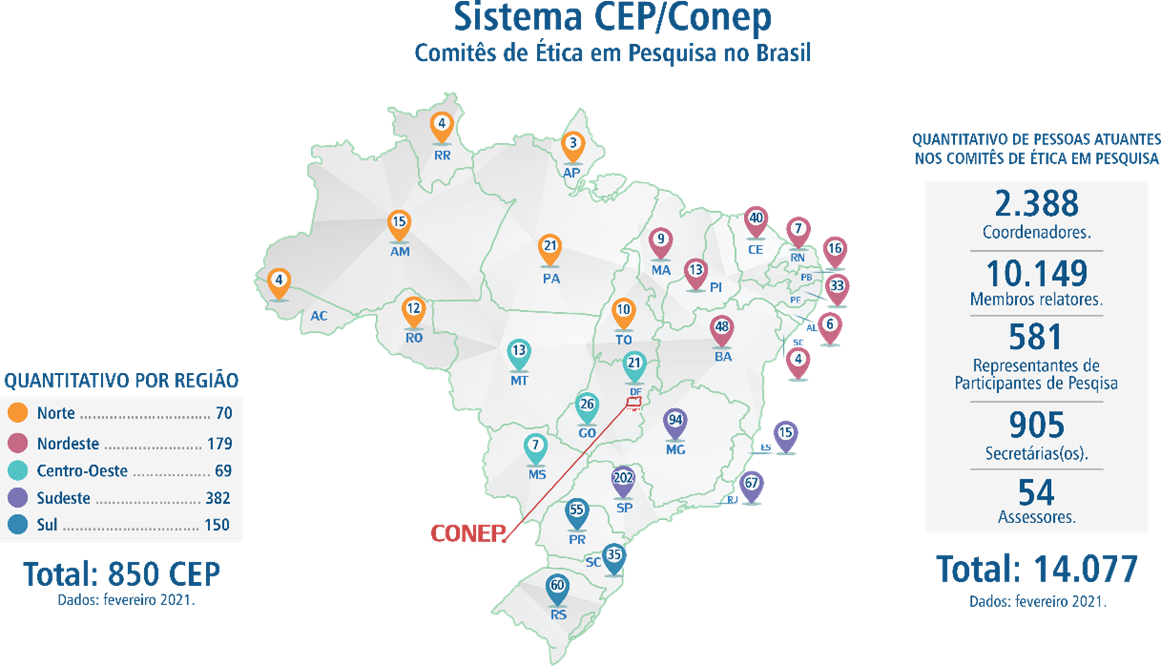
Em relação às questões éticas envolvidas nesses estudos, as agências reguladoras contam com a importante contribuição dos Comitês de Ética em Pesquisa. No Brasil, a regulação ética da pesquisa que envolve seres humanos, incluindo os estudos clínicos, é de responsabilidade desses Comitês de Ética em Pesquisa (CEPs) que estão distribuídos em todas as regiões do país. Segundo o Mapa de CEPs,18 até fevereiro de 2021, o Brasil contava com 850 CEPs.
Figura 1. Mapa de CEPs. Fonte: Conselho Nacional de Saúde, 2021.1
Os CEPs “são colegiados interdisciplinares e independentes, de relevância pública, de caráter consultivo, deliberativo e educativo, criados para defender os interesses dos participantes da pesquisa em sua integridade e dignidade e para contribuir no desenvolvimento da pesquisa dentro de padrões éticos.”19 Esses Comitês são vinculados à Comissão Nacional de Ética em Pesquisa, conhecida como Conep. Ligada ao Conselho Nacional de Saúde (CNS), cabe à Conep a elaboração e a atualização das normas que protegem o indivíduo que participa da pesquisa. Dentre essas normas, destaca-se a Resolução CNS 466 de 2012.
A Resolução CNS 466/12 “visa assegurar os direitos e deveres que dizem respeito aos participantes da pesquisa, à comunidade científica e ao Estado,”20 como descrito em suas disposições preliminares. A Resolução 466 tem um papel muito importante na regulação ética da pesquisa clínica. Ela estabelece que todo participante precisa ser esclarecido sobre os objetivos, os métodos, os possíveis benefícios e potenciais riscos envolvidos em sua participação. No Brasil não é permitido qualquer tipo de pagamento aos participantes, a não ser em casos especificados na Resolução.
A Conep, ao elaborar e atualizar as diretrizes para a proteção dos participantes de pesquisa, considera que pesquisas em seres humanos e questões éticas são indissociáveis. Na apreciação ética dos projetos propostos, os CEPs avaliam, por exemplo, a clareza na descrição de riscos e benefícios, tanto os conhecidos quanto os potenciais, para os seres humanos – participantes da pesquisa. Dentre os aspectos éticos observados pelos CEPs estão aqueles relacionados à vulnerabilidade. Tanto os CEPs quanto os pesquisadores devem estar atentos para que o estudo proposto não acentue situações de vulnerabilidade para os participantes e para as comunidades envolvidas.
De forma geral, na apreciação ética de projetos que pretendem envolver seres humanos na pesquisa, os CEPs têm um importante papel social. Esses Comitês contribuem, de forma decisiva, para garantir a segurança dos participantes, com especial atenção aos direitos e à dignidade desses indivíduos. No campo da regulação ética da pesquisa em seres humanos, apesar do Brasil, por meio do Sistema CEP/Conep, apresentar características específicas, o país compartilha princípios éticos internacionais. Para o Sistema CEP/Conep, dentre as características de uma pesquisa ética em seres humanos está a garantia de que a vontade dos participantes de pesquisa de contribuir e permanecer ou não no estudo seja manifestada de forma expressa, livre e esclarecida.
No âmbito das pesquisas envolvendo seres humanos,21 conduzidas na pandemia de COVID-19, a ética em pesquisa continua tendo um papel crucial. No que tange os estudos com desafio em humanos, o debate internacional em curso vem sendo modulado e enriquecido por questões éticas que deverão se ampliar com a perspectiva de diferentes atores, como pesquisadores, membros de Comitês de Ética em Pesquisa e do público, em diferentes países. Neste cenário de transformações, em que “a COVID-19 virou o mundo de cabeça para baixo,”1 a ética em pesquisa permanece sendo uma grande aliada para aprofundar reflexões e nortear decisões que são tomadas na interface ciência e sociedade.
Assista ao vídeo “Aspectos éticos e regulatórios sobre a pesquisa em seres humanos na pandemia de COVID-19”, produzido pelo Laboratório de Ética em Pesquisa, Comunicação Científica e Sociedade (LECCS) do Instituto de Bioquímica Médica Leopoldo de Meis (IBqM)/UFRJ.
A versão desse mesmo conteúdo está disponível no vídeo abaixo, com elementos de acessibilidade.
Agradecimentos
Agradecemos aos pós-graduandos Cleide Lima, Fernanda Victorio, do Programa de Mestrado Profissional em Educação, Gestão e Difusão em Biociências (IBqM/UFRJ) e Marlon Machado, do Programa de Química Biológica – área de concentração Educação, Gestão e Difusão em Biociências – (IBqM/UFRJ), pela colaboração para a elaboração do vídeo associado a esta publicação.
Notas
*Programa de Química Biológica – área de concentração Educação, Gestão e Difusão em Biociências – Instituto de Bioquímica Médica Leopoldo de Meis (IBqM), Universidade Federal do Rio de Janeiro (UFRJ), Brasil.
**Programa de Mestrado Profissional em Educação, Gestão e Difusão em Biociências, IBqM/UFRJ.
***Colégio Pedro II
1. Committee for the Coordination of Statistical Activities. How COVID-19 is changing the world: a statistical perspective [online]. United Nations Statistical Commission. 2020 [viewed 28 April 2021]. Available from: https://unstats.un.org/unsd/ccsa/documents/covid19-report-ccsa.pdf
2. Lei no. 13.979, de 6 de fevereiro de 2020 [online]. Diário Oficial da União. 2020 [viewed 28 April 2021]. Available from: https://www.in.gov.br/en/web/dou/-/lei-n-13.979-de-6-de-fevereiro-de-2020-242078735
3. Folha informativa sobre COVID-19 | Organização Pan-Americana da Saúde: https://www.paho.org/pt/covid19
4. ORGANIZAÇÃO PAN-AMERICANA DA SAÚDE. Perguntas frequentes sobre as vacinas candidatas contra a COVID-19 e os mecanismos de acesso. [online]. Institutional Repository for Information Sharing (IRIS). 2021 [viewed 28 April 2021]. Available from: https://iris.paho.org/handle/10665.2/52669
5. COVID-19 clinical trials have increased by 639% with the US leading the way [online]. Global Data. 2021 [viewed 28 April 2021]. Available from: https://www.globaldata.com/covid-19-clinical-trials-increased-639-us-leading-way/
6. EYAL, N., CAPLAN, A. and PLOTKIN, S. Human challenge trials of COVID-19 vaccines still have much to teach us [online]. The BJM Opinion, 2021 [viewed 28 April 2021]. Available from: https://blogs.bmj.com/bmj/2021/01/08/human-challenge-trials-of-covid-19-vaccines-still-have-much-to-teach-us/
7. Ensaios clínicos [online]. Instituto Butantan [viewed 28 April 2021]. Available from: https://butantan.gov.br/pesquisa/ensaios-clinicos
8. JAMROZIK, E., et al. Key criteria for the ethical acceptability of COVID-19 human challenge studies: Report of a WHO Working Group. Vaccine [online]. 2021, vol. 39, no. 4, pp. 633-640 [viewed 28 April 2021]. https://doi.org/10.1016/j.vaccine.2020.10.075. Available from: https://bit.ly/3xy3E9e
9. HASFORD, J. Covid-19: Human challenge studies will see people purposefully infected with virus. BMJ [online]. 2020, m4101 [viewed 28 April 2021]. https://doi.org/10.1136/bmj.m4101. Available from: https://www.bmj.com/lookup/doi/10.1136/bmj.m4101
10. COHEN, J. Controversial ‘human challenge’ trials for COVID-19 vaccines gain support [online]. Science. 2020 [viewed 28 April 2021]. http://doi.org/10.1126/science.abd9203. Available from: https://www.sciencemag.org/news/2020/07/controversial-human-challenge-trials-covid-19-vaccines-gain-support
11. McPARTLIN, S.O., et al. COVID-19 vaccines: Should we allow human challenge studies to infect healthy volunteers with SARS-CoV-2? BMJ [online]. 2020, m4258 [viewed 28 April 2021]. https://doi.org/10.1136/bmj.m4258. Available from: https://www.bmj.com/lookup/doi/10.1136/bmj.m4258
12. WHO. Key criteria for the ethical acceptability of COVID-19 human challenge studies [online]. World Health Organization. 2020 [viewed 28 April 2021]. Available from: https://www.who.int/ethics/publications/key-criteria-ethical-acceptability-of-covid-19-human-challenge/en
13. Em fevereiro, um press release no site GOV.UK, anunciou o primeiro estudo com desafio em humanos sobre COVID-19, oficialmente aprovado (incluindo a instância de apreciação ética) no Reino Unido. Como descrito no documento, “up to 90 volunteers aged 18-30 years will be exposed to Covid-19 in a safe and controlled environment to increase understanding of how the virus affects people.”
14. Não foram identificadas menções a “challenge trials”, “human challenge studies”, em uma busca em 05.04.2021, para todos os países indicados na base ClinRegs.
15. Conducting Clinical Trials [online]. U.S. Food & Drug Administration. 2020 [viewed 28 April 2021]. Available from: https://www.fda.gov/drugs/development-approval-process-drugs/conducting-clinical-trials
16. Institutional Review Boards (IRBs) and Protection of Human Subjects in Clinical Trials [online]. U.S. Food & Drug Administration. 2019 [viewed 28 April 2021]. Available from: https://www.fda.gov/about-fda/center-drug-evaluation-and-research-cder/institutional-review-boards-irbs-and-protection-human-subjects-clinical-trials
17. Ensaios Clínicos [online]. Anvisa [viewed 28 April 2021]. Available from: https://bit.ly/3u28nxJ
18. COMISSÃO NACIONAL DE ÉTICA EM PESQUISA. Cartilha dos Direitos dos Participantes de Pesquisa [online]. 2020 [viewed 28 April 2021]. Available from: http://gg.gg/l70q5
19. Resolução No 466, de 12 de dezembro de 2012 [online]. Conselho Nacional de Saúde. 2012 [viewed 28 April 2021]. Available from: https://bvsms.saude.gov.br/bvs/saudelegis/cns/2013/res0466_12_12_2012.html
20. Comissão Nacional de Ética em Pesquisa [online]. Conselho Nacional de Saúde [viewed 28 April 2021]. Available from: http://conselho.saude.gov.br/comissoes-cns/conep
21. Como pode ser notado, o foco desta perspectiva é sobre a ética na pesquisa “em humanos,” pela natureza das pesquisas abordadas. A ética na pesquisa “com humanos,” com metodologias típicas das ciências humanas e sociais, possui uma série de especificidades, não exploradas nesta contribuição e no vídeo associado. No Brasil, a principal Resolução do Conselho Nacional de Saúde (CNS), com diretrizes para a pesquisa “com humanos,” é a 510/2016.
Referências
CALLAWAY, E. Dozens to be deliberately infected with coronavirus in UK ‘human challenge’ trials. Nature [online]. 2020, vol. 586, no. 7831, pp. 651-652 [viewed 28 April 2021]. https://doi.org/10.1038/d41586-020-02821-4. Available from: https://www.nature.com/articles/d41586-020-02821-4
COHEN, J. Controversial ‘human challenge’ trials for COVID-19 vaccines gain support [online]. Science. 2020 [viewed 28 April 2021]. http://doi.org/10.1126/science.abd9203. Available from: https://www.sciencemag.org/news/2020/07/controversial-human-challenge-trials-covid-19-vaccines-gain-support
COHEN, J. Studies that intentionally infect people with disease-causing bugs are on the rise [online]. Science. 2016 [viewed 28 April 2021]. http://doi.org/10.1126/science.aaf5726. Available from: https://www.sciencemag.org/news/2016/05/studies-intentionally-infect-people-disease-causing-bugs-are-rise
Comissão Nacional de Ética em Pesquisa [online]. Conselho Nacional de Saúde [viewed 28 April 2021]. Available from: http://conselho.saude.gov.br/comissoes-cns/conep
COMISSÃO NACIONAL DE ÉTICA EM PESQUISA. Cartilha dos Direitos dos Participantes de Pesquisa [online]. 2020 [viewed 28 April 2021]. Available from: http://gg.gg/l70q5
Committee for the Coordination of Statistical Activities. How COVID-19 is changing the world: a statistical perspective [online]. United Nations Statistical Commission. 2020 [viewed 28 April 2021]. Available from: https://unstats.un.org/unsd/ccsa/documents/covid19-report-ccsa.pdf
Conducting Clinical Trials [online]. U.S. Food & Drug Administration. 2020 [viewed 28 April 2021]. Available from: https://www.fda.gov/drugs/development-approval-process-drugs/conducting-clinical-trials
COVID-19 clinical trials have increased by 639% with the US leading the way [online]. Global Data. 2021 [viewed 28 April 2021]. Available from: https://www.globaldata.com/covid-19-clinical-trials-increased-639-us-leading-way/
CRODA, J.H.R. AND GARCIA, L.P. Resposta imediata da Vigilância em Saúde à epidemia da COVID-19. Epidemiol. Serv. Saúde [online]. 2020, vol. 29, no. 1, e2020002 [viewed 28 April 2021]. https://doi.org/10.5123/s1679-49742020000100021. Available from: http://ref.scielo.org/rmzvjn
Ensaios Clínicos [online]. Anvisa [viewed 28 April 2021]. Available from: https://bit.ly/3u28nxJ
Ensaios clínicos [online]. Instituto Butantan [viewed 28 April 2021]. Available from: https://butantan.gov.br/pesquisa/ensaios-clinicos
Ensaios clínicos com medicamentos aprovados para prevenção ou tratamento da COVID-19 [online]. Agência Nacional de Vigilância Sanitária [viewed 28 April 2021]. Available from: http://antigo.anvisa.gov.br/estudos-clinicos-covid-19
Ensaios clínicos em andamento [online]. Portal Fiocruz. 2021 [viewed 28 April 2021]. Available from: https://portal.fiocruz.br/vacina-covid-19-ensaios-clinicos
EYAL, N. Why Challenge Trials of SARS‐CoV‐2 Vaccines could be ethical despite risk of severe adverse events. Ethics Hum Res [online]. 2020, vol. 42, no. 4, pp. 24–34 [viewed 28 April 2021]. https://doi.org/10.1002/eahr.500056. Available from: https://onlinelibrary.wiley.com/doi/abs/10.1002/eahr.500056
EYAL, N., CAPLAN, A. and PLOTKIN, S. Human challenge trials of COVID-19 vaccines still have much to teach us [online]. The BJM Opinion, 2021 [viewed 28 April 2021]. Available from: https://blogs.bmj.com/bmj/2021/01/08/human-challenge-trials-of-covid-19-vaccines-still-have-much-to-teach-us/
HASFORD, J. Covid-19: Human challenge studies will see people purposefully infected with virus. BMJ [online]. 2020, m4101 [viewed 28 April 2021]. https://doi.org/10.1136/bmj.m4101. Available from: https://www.bmj.com/lookup/doi/10.1136/bmj.m4101
Human Coronavirus Types [online]. Centers for Disease Control and Prevention. 2020 [viewed 28 April 2021]. Available from: https://www.cdc.gov/coronavirus/types.html
Institutional Review Boards (IRBs) and Protection of Human Subjects in Clinical Trials [online]. U.S. Food & Drug Administration. 2019 [viewed 28 April 2021]. Available from: https://www.fda.gov/about-fda/center-drug-evaluation-and-research-cder/institutional-review-boards-irbs-and-protection-human-subjects-clinical-trials
JAMROZIK, E. and SELGELID, M.J. COVID-19 human challenge studies: ethical issues. Lancet Infect Dis [online]. 2020, vol. 20, no. 8, e198–203 [viewed 28 April 2021]. https://doi.org/10.1016/S1473-3099(20)30438-2. Available from: https://bit.ly/339lFwV
JAMROZIK, E., et al. Key criteria for the ethical acceptability of COVID-19 human challenge studies: Report of a WHO Working Group. Vaccine [online]. 2021, vol. 39, no. 4, pp. 633-640 [viewed 28 April 2021]. https://doi.org/10.1016/j.vaccine.2020.10.075. Available from: https://bit.ly/3xy3E9e
JOKURA, T. Distribution challenges [online]. Pesquisa FAPESP. 2021 [viewed 28 April 2021]. Available from: https://revistapesquisa.fapesp.br/en/distribution-challenges/
Lei no. 13.979, de 6 de fevereiro de 2020 [online]. Diário Oficial da União. 2020 [viewed 28 April 2021]. Available from: https://www.in.gov.br/en/web/dou/-/lei-n-13.979-de-6-de-fevereiro-de-2020-242078735
LEWIS, P. COVID-19: Health literacy and public health information [online]. House of Lords Library, 2020 [viewed 28 April 2021]. Available from: https://lordslibrary.parliament.uk/covid-19-health-literacy-and-public-health-information/
Listings of WHO’s response to COVID-19 [online]. World Health Organization. 2020 [viewed 28 April 2021]. Available from: https://www.who.int/news/item/29-06-2020-covidtimeline
MARON, D.F. “Wet markets” likely launched the coronavirus. Here’s what you need to know. [online]. National Geographic. 2020 [viewed 28 April 2021]. Available from: https://www.nationalgeographic.com/animals/article/coronavirus-linked-to-chinese-wet-markets
McPARTLIN, S.O., et al. COVID-19 vaccines: Should we allow human challenge studies to infect healthy volunteers with SARS-CoV-2? BMJ [online]. 2020, m4258 [viewed 28 April 2021]. https://doi.org/10.1136/bmj.m4258. Available from: https://www.bmj.com/lookup/doi/10.1136/bmj.m4258
MURRAY, C.J.L., et al. Digital public health and COVID-19. The Lancet Public Health [online]. 2020, vol. 5, no. 9, e469–e470 [viewed 28 April 2021]. https://doi.org/10.1016/S2468-2667(20)30187-0. Available from: https://bit.ly/3xvacW5
Naming the coronavirus disease (COVID-19) and the virus that causes it [online]. World Health Organization. 2020 [viewed 28 April 2021]. Available from: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/technical-guidance/naming-the-coronavirus-disease-(covid-2019)-and-the-virus-that-causes-it
ORGANIZAÇÃO PAN-AMERICANA DA SAÚDE. Perguntas frequentes sobre as vacinas candidatas contra a COVID-19 e os mecanismos de acesso. [online]. Institutional Repository for Information Sharing (IRIS). 2021 [viewed 28 April 2021]. Available from: https://iris.paho.org/handle/10665.2/52669
PAAKKARI, L. and OKAN, O. COVID-19: Health literacy is an underestimated problem. The Lancet Public Health [online]. 2020, vol. 5, no. 5, e249-250 [viewed 28 April 2021]. https://doi.org/10.1016/S2468-2667(20)30086-4. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7156243/
PARKER, L. To find a vaccine for COVID-19, will we have to deliberately infect people? [online]. National Geographic. 2020 [viewed 28 April 2021]. Available from: https://www.nationalgeographic.co.uk/science-and-technology/2020/09/to-find-a-vaccine-for-covid-19-will-we-have-to-deliberately-infect
Resolução No 466, de 12 de dezembro de 2012 [online]. Conselho Nacional de Saúde. 2012 [viewed 28 April 2021]. Available from: https://bvsms.saude.gov.br/bvs/saudelegis/cns/2013/res0466_12_12_2012.html
RUBIN, R. Challenge Trials—Could Deliberate Coronavirus Exposure Hasten Vaccine Development? JAMA [online]. 2020, vol. 324, no. 1, pp. 12-14 [viewed 28 April 2021]. http://doi.org/10.1001/jama.2020.9881. Available from: https://jamanetwork.com/journals/jama/fullarticle/2767024/
Timeline: WHO’s COVID-19 response [online]. World Health Organization. 2021 [viewed 28 April 2021]. Available from: https://bit.ly/32YpPHA
UNITED NATIONS DEPARTMENT OF GLOBAL COMMUNICATIONS. 5 ways the UN is fighting ‘infodemic’ of misinformation [online]. United Nations. 2020 [viewed 28 April 2021]. Available from: https://www.un.org/en/un-coronavirus-communications-team/five-ways-united-nations-fighting-‘infodemic’-misinformation
Update on COVID-19 vaccine development [online]. World Health Organization. 2020 [viewed 28 April 2021]. Available from: https://www.who.int/docs/default-source/coronaviruse/risk-comms-updates/update45-vaccines-developement.pdf?sfvrsn=13098bfc_5
WHO calls for further studies, data on origin of SARS-CoV-2 virus, reiterates that all hypotheses remain open [online]. World Health Organization. 2021 [viewed 28 April 2021]. Available from: https://www.who.int/news/item/30-03-2021-who-calls-for-further-studies-data-on-origin-of-sars-cov-2-virus-reiterates-that-all-hypotheses-remain-open
WHO Director-General’s opening remarks at the media briefing on COVID-19 – 11 March 2020 [online]. World Health Organization. 2020 [viewed 28 April 2021]. Available from: https://www.who.int/director-general/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19—11-march-2020
WHO. Key criteria for the ethical acceptability of COVID-19 human challenge studies [online]. World Health Organization. 2020 [viewed 28 April 2021]. Available from: https://www.who.int/ethics/publications/key-criteria-ethical-acceptability-of-covid-19-human-challenge/en
World Health Organization (WHO) [social network]. In: @WHO [online]. Twitter, March 11, 2020 [viewed 28 April 2021]. Available from: https://twitter.com/WHO/status/1237777021742338049
YAN, W. Challenge accepted: Human challenge trials for dengue. Nat Med [online]. 2015, vol. 21, no. 8, pp. 828–830 [viewed 28 April 2021]. https://doi.org/10.1038/nm0815-828. Available from: http://www.nature.com/articles/nm0815-828
Links externos
1Day Sooner: https://www.1daysooner.org/
Agência Nacional de Vigilância Sanitária – Anvisa: https://www.gov.br/anvisa/pt-br
ClinRegs: https://clinregs.niaid.nih.gov/
Conselho Nacional de Saúde – Mapa dos CEPs: http://conselho.saude.gov.br/contato-cns/93-comissoes/conep/comites-de-etica-em-pesquisa-conep/645-mapa-dos-ceps-conep
Folha informativa sobre COVID-19 | Organização Pan-Americana da Saúde: https://www.paho.org/pt/covid19
Linha do tempo coronavírus: https://coronavirus.saude.gov.br/linha-do-tempo/
WHO Coronavirus (COVID-19) Dashboard | WHO Coronavirus (COVID-19) Dashboard With Vaccination Data: https://covid19.who.int/
Revisado em 25 Abril, 2022.
Como citar este post [ISO 690/2010]:




![Relatório da pesquisa sobre prioridades da comunidade OJS [Publicado originalmente no site do PKP] Relatório da pesquisa sobre prioridades da comunidade OJS [Publicado originalmente no site do PKP]](https://blog.scielo.org/wp-content/uploads/2022/01/jonny-gios-SqjhKY9877M-unsplash_thumb.jpg)












Últimos comentários